C'è una buona notizia per chi teme la malattia di Lyme: è iniziata l'ultima fase di sperimentazione per un nuovo vaccino. Se i risultati saranno positivi, questo potrebbe rappresentare un passo importante nella lotta contro questa diffusa infezione trasmessa da zecche.
La malattia di Lyme, se non diagnosticata e curata in tempo, può causare seri problemi di salute, tra cui artrite, problemi cardiaci e neurologici.
Al momento non esiste un vaccino disponibile, ma la sperimentazione in corso, condotta da Pfizer e Valneva, potrebbe finalmente offrire una valida protezione contro questa malattia.
Pfizer Inc. e Valneva hanno annunciato l'avvio di uno studio clinico di Fase 3, chiamato VALOR, per valutare l'efficacia, la sicurezza e l'immunogenicità del loro candidato vaccino contro la malattia di Lyme.
"Con l'aumento globale dei casi di malattia di Lyme, offrire una nuova opzione per proteggersi è più importante che mai," ha detto Annaliesa Anderson, Ph.D., Vicepresidente Senior e Responsabile della Ricerca e Sviluppo sui Vaccini presso Pfizer. "Speriamo che i dati generati dallo studio di Fase 3 possano confermare le prove positive su VLA15 raccolte fino a oggi, e siamo entusiasti di collaborare con i siti di ricerca negli Stati Uniti e in Europa per questo importante trial."
Juan Carlos Jaramillo, M.D., Chief Medical Officer di Valneva, ha dichiarato: "Siamo estremamente lieti di raggiungere questo importante traguardo nello sviluppo di VLA15. La malattia di Lyme continua a diffondersi, rappresentando un'esigenza medica significativa che colpisce molte persone nell'emisfero settentrionale. Non vediamo l'ora di approfondire ulteriormente il candidato VLA15 nella Fase 3, avvicinandoci così a offrire questo vaccino sia agli adulti che ai bambini che ne beneficerebbero."
Lo studio VALOR di Fase 3, randomizzato e controllato con placebo, prevede di arruolare circa 6.000 partecipanti dai 5 anni in su. Lo studio si svolge in fino a 50 siti situati in aree dove la malattia di Lyme è altamente endemica, inclusi Finlandia, Germania, Paesi Bassi, Polonia, Svezia e Stati Uniti. I partecipanti riceveranno tre dosi di VLA15 180 µg o placebo salino come serie di vaccinazione primaria, seguite da una dose di richiamo di VLA15 o placebo salino (rapporto 1:1).
I dati degli studi di Fase 2 continuano a dimostrare una forte risposta immunitaria negli adulti e nei bambini, con profili di sicurezza e tollerabilità accettabili in entrambe le popolazioni studiate. In caso di successo dello studio di Fase 3, Pfizer potrebbe presentare una domanda di licenza per biologici (BLA) alla Food and Drug Administration (FDA) degli Stati Uniti e una domanda di autorizzazione all'immissione in commercio (MAA) all'Agenzia Europea per i Medicinali (EMA) nel 2025.
Secondo i termini dell'accordo di collaborazione tra Pfizer e Valneva, Pfizer effettuerà un pagamento di 25 milioni di dollari a Valneva all'inizio dello studio di Fase 3.
VLA15 è l'unico candidato vaccino contro la malattia di Lyme attualmente in sviluppo clinico. Questo vaccino sperimentale multivalente a base di proteine utilizza un meccanismo d'azione consolidato per un vaccino contro la malattia di Lyme che prende di mira la proteina di superficie esterna A (OspA) del Borrelia burgdorferi, il batterio che causa la malattia di Lyme.
OspA è una proteina di superficie espressa dal batterio quando è presente in una zecca. Bloccando OspA, si inibisce la capacità del batterio di lasciare la zecca e infettare gli esseri umani. Il vaccino copre i sei sierotipi di OspA più comuni espressi dalle specie Borrelia burgdorferi sensu lato, prevalenti in Nord America e in Europa.
VLA15 ha dimostrato una forte risposta immunitaria e un profilo di sicurezza soddisfacente negli studi preclinici e clinici fino a oggi. Valneva e Pfizer hanno stretto un accordo di collaborazione nell'aprile 2020 per co-sviluppare VLA15, con aggiornamenti ai termini dell'accordo effettuati nel giugno 2022.
I termini dell'accordo di collaborazione includono un pagamento di 25 milioni di dollari a Valneva all'inizio dello studio di Fase 3. Il programma ha ricevuto la designazione Fast Track dalla FDA statunitense nel luglio 2017.
La malattia di Lyme è un'infezione sistemica causata dal batterio Borrelia burgdorferi trasmesso agli esseri umani dalle zecche infette del genere Ixodes. È considerata la malattia trasmessa da vettori più comune nell'emisfero settentrionale.
Sebbene l'incidenza reale della malattia di Lyme sia sconosciuta, si stima che colpisca annualmente circa 476.000 persone negli Stati Uniti e 130.000 persone in Europa.
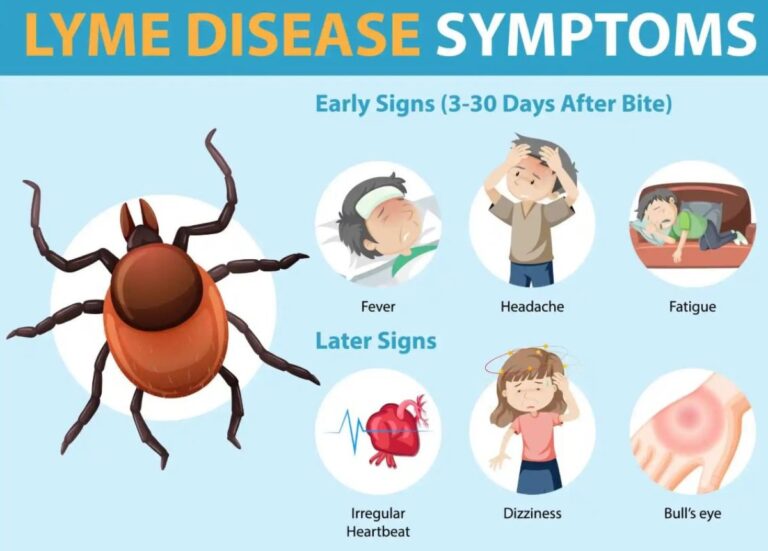
I sintomi precoci della malattia di Lyme (come un'eruzione cutanea chiamata Eritema migrante o sintomi più generici come affaticamento, febbre, mal di testa, lieve rigidità del collo, artralgia o mialgia) sono spesso trascurati o interpretati erroneamente.
Se non trattata, la malattia può diffondersi e causare complicazioni più gravi che colpiscono le articolazioni (artrite), il cuore (cardite) o il sistema nervoso. La necessità di un vaccino contro la malattia di Lyme è in costante aumento, man mano che la diffusione geografica della malattia si amplia sempre più.
Il tuo indirizzo email non sarà pubblicato.
I campi obbligatori sono contrassegnati con *